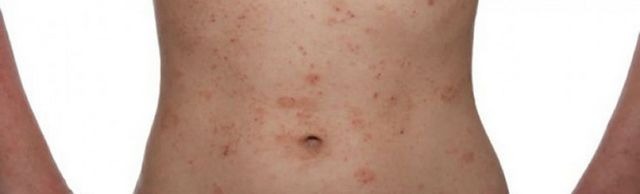
Η Sanofi και η Regeneron Pharmaceuticals, ανακοίνωσαν τα δημοσιευμένα αποτελέσματα από το ιατρικό περιοδικό «The New England Journal of Medicine» (NEJM), των μελετών LIBERTYADSOLO 1 και SOLO 2, οι οποίες αξιολόγησαν το υπό έρευνα Dupilumab σε ενήλικες ασθενείς με ανεπαρκώς ελεγχόμενη μέτρια έως σοβαρή ατοπική δερματίτιδα (ΑΔ).
Οι μελέτες πέτυχαν τα πρωτεύοντα καταληκτικά σημεία τους που αξιολόγησαν την έκταση και τη σοβαρότητα της νόσου. Επιπλέον, και οι δύο κλινικές μελέτες πέτυχαν τα κύρια δευτερεύοντα καταληκτικά σημεία που αφορούν τη μέτρηση παραμέτρων που σχετίζονται με τη μείωση του κνησμού, τη βελτίωση των αναφερόμενων από τον ασθενή συμπτωμάτων άγχους και κατάθλιψης, καθώς και κάποιων παραμέτρων που συνδέονται με την ποιότητα ζωής.
Το Dupilumab αναστέλλει τον σηματοδοτικό μηχανισμό τωνIL-4 και IL-13, δύο βασικών κυτοκινών που απαιτούνται για την ανοσολογική απάντηση τύπου 2 (συμπεριλαμβανομένης της Τh2), η οποία πιστεύεται ότι αποτελεί σημαντικό παράγοντα στην ΑΔ και σε κάποιες ατοπικές ή αλλεργικές νόσους, μεταξύ των οποίων το άσθμα και η ρινική πολυποδίαση, πεδία στα οποία το Dupilumab αξιολογείται στο πλαίσιο κλινικών μελετών που βρίσκονται σε εξέλιξη.
Το πρόγραμμα κλινικών μελετών Φάσης 3 LibertyAD περιλαμβάνει πέντε μελέτες ασθενών με μέτρια έως σοβαρή ατοπική δερματίτιδα που διενεργούνται σε τοποθεσίες ανά τον κόσμο. Συνολικά 1.379 ενήλικες ασθενείς με μέτρια έως σοβαρή ΑΔ συμπεριλήφθηκαν στις πανομοιότυπα σχεδιασμένες μελέτες SOLO 1 και SOLO 2. Οι ασθενείς συμπεριλήφθηκαν στις μελέτες με κριτήριο τον ανεπαρκή έλεγχο των συμπτωμάτων μετά από τοπική θεραπεία ή εφόσον δεν συστηνόταν η χορήγηση τοπικής θεραπείας. Όλοι οι ασθενείς αξιολογήθηκαν με βάση την 5-βάθμια κλίμακα Συνολικής Αξιολόγησης του Ερευνητή (Investigator's Global Assessment-IGA), που περιλάμβανε τις βαθμίδες 0 (χωρίς δερματικές βλάβες) έως 4 (σοβαρή δερματική βλάβη)· σύμφωνα με τα κριτήρια ένταξης μόνο ασθενείς με αξιολόγηση IGA 3 ή 4 εντάχθηκαν στη μελέτη. Οι ασθενείς επίσης αξιολογήθηκαν με βάση τον δείκτη EASI (Eczema Area and Severity Index/Δείκτης Έκτασης και Βαρύτητας του Εκζέματος), καθώς και με άλλα κριτήρια. Οι ασθενείς τυχαιοποιήθηκαν σε τρεις ομάδες θεραπείας: Dupilumab 300 mg υποδορίως μία φορά την εβδομάδα, Dupilumab 300 mg υποδορίως κάθε δύο εβδομάδες ή εικονικό φάρμακο για 16 εβδομάδες μετά από τη χορήγηση αρχικής δόσης Dupilumab 600 mg υποδορίως ή εικονικού φαρμάκου.
Όπως δήλωσε ο Eric Simpson, M.D., M.C.R., Oregon Health & Science University, και κύριος συγγραφέας του άρθρου που δημοσιεύεται στο περιοδικό NEJM, αυτά τα αποτελέσματα υποστηρίζουν τον αυξανόμενο όγκο δεδομένων για το Dupilumab ως μία δυνητική νέα θεραπευτική επιλογή για ασθενείς με μέτρια έως σοβαρή ατοπική δερματίτιδα οι οποίοι πασχίζουν να ελέγξουν την ασθένειά τους. Επιπλέον, η μείωση της έντασης του κνησμού είναι σημαντική καθώς αποτελεί ένα από τα πιο ενοχλητικά συμπτώματα για τους ασθενείς και είναι δυνατό να επηρεάζει και άλλους τομείς της ζωής τους, όπως είναι ο ύπνος.
Η αίτηση για χορήγηση άδειας βιολογικού προϊόντος για το Dupilumab (BLA) έγινε πρόσφατα δεκτή από τον Αμερικανικό Οργανισμό Τροφίμων και Φαρμάκων (FDA) για εξέταση κατά προτεραιότητα, με ημερολογιακό στόχο την 29η Μαρτίου, 2017. Ο Αμερικανικός Οργανισμός Τροφίμων και Φαρμάκων (FDA) χαρακτήρισε το Dupilumab ως Πρωτοποριακή Θεραπεία για την μη ελεγχόμενη μέτρια έως σοβαρή ατοπική δερματίτιδα το 2014.
Το Dupilumab επί του παρόντος βρίσκεται υπό κλινική ανάπτυξη και η ασφάλεια και η αποτελεσματικότητά του δεν έχουν αξιολογηθεί πλήρως από καμία ρυθμιστική αρχή. Εκτός από την ΑΔ, το Dupilumab αξιολογείται για τη θεραπεία του άσθματος, της ρινικής πολυποδίασης και της ηωσινοφιλικής οισοφαγίτιδας. Εφόσον λάβει έγκριση, η εμπορική διάθεση του Dupilumab θα πραγματοποιείται από τη Regeneron και τη Sanofi Genzyme, την παγκόσμια επιχειρησιακή μονάδα εξειδικευμένης φροντίδας της Sanofi.